Datasource not set for Events Deck
Contacte a nossa equipa
Porque todos os dias contam!
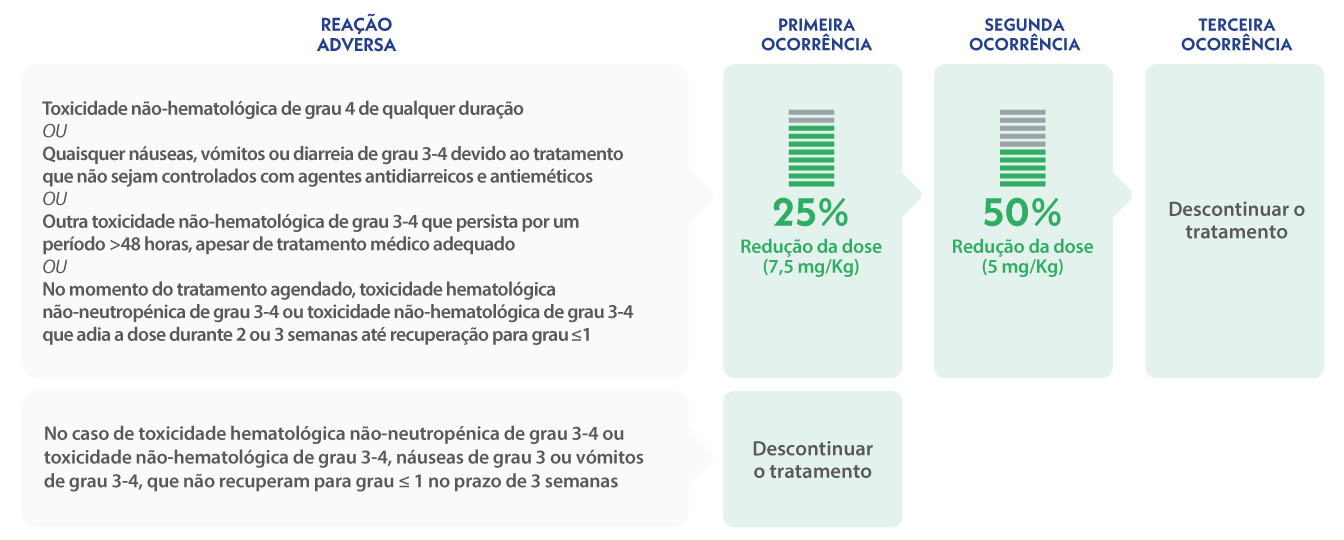
Modificações de dose recomendadas em caso de neutropenia grave9
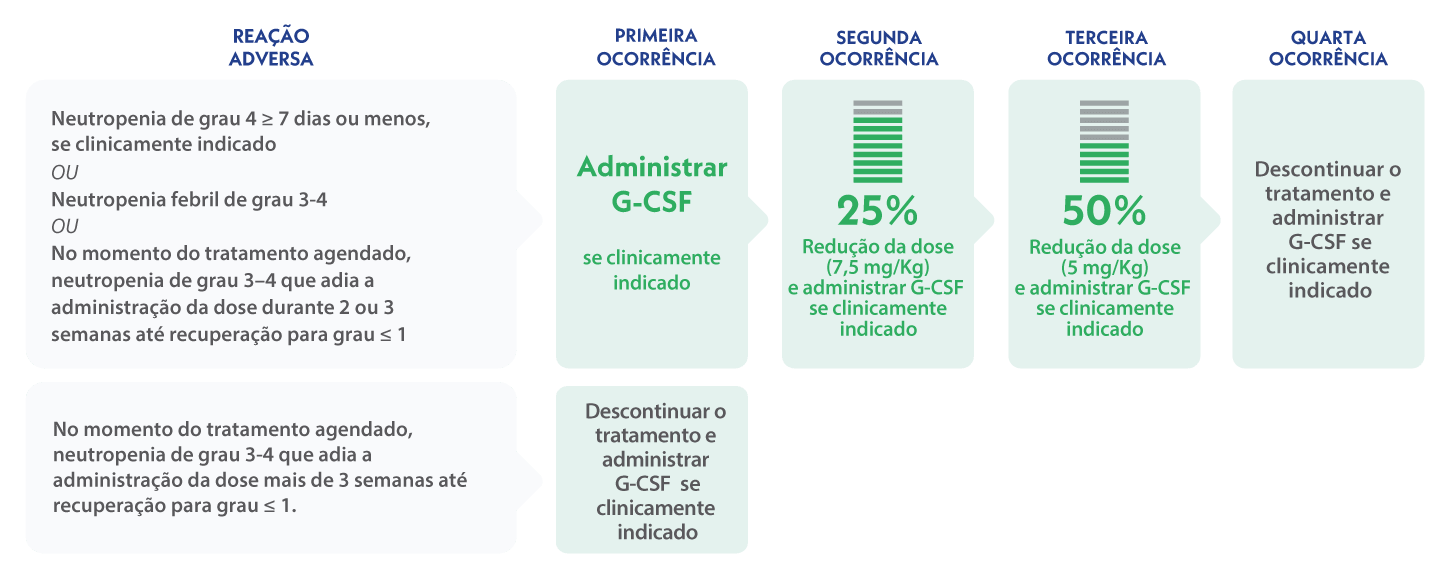
- A dose de sacituzumab govitecano não deve ser aumentada após ter sido realizada uma redução de dose devido a reações adversas9.
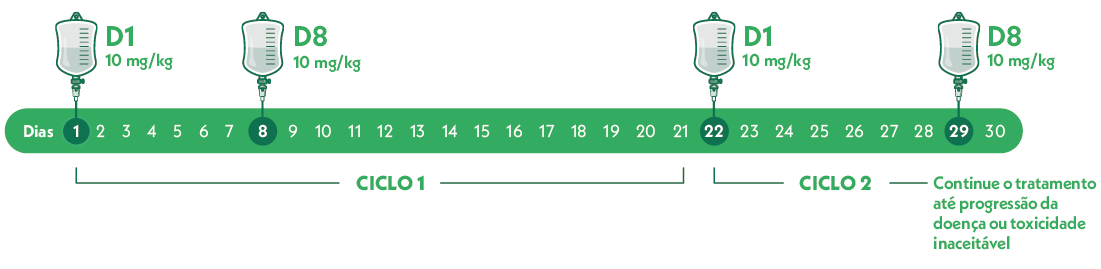
- O intervalo entre a dose do Dia 8 e a dose do Dia 1 do novo ciclo tem de ser no mínimo de 14 dias e um máximo de 21 dias18.
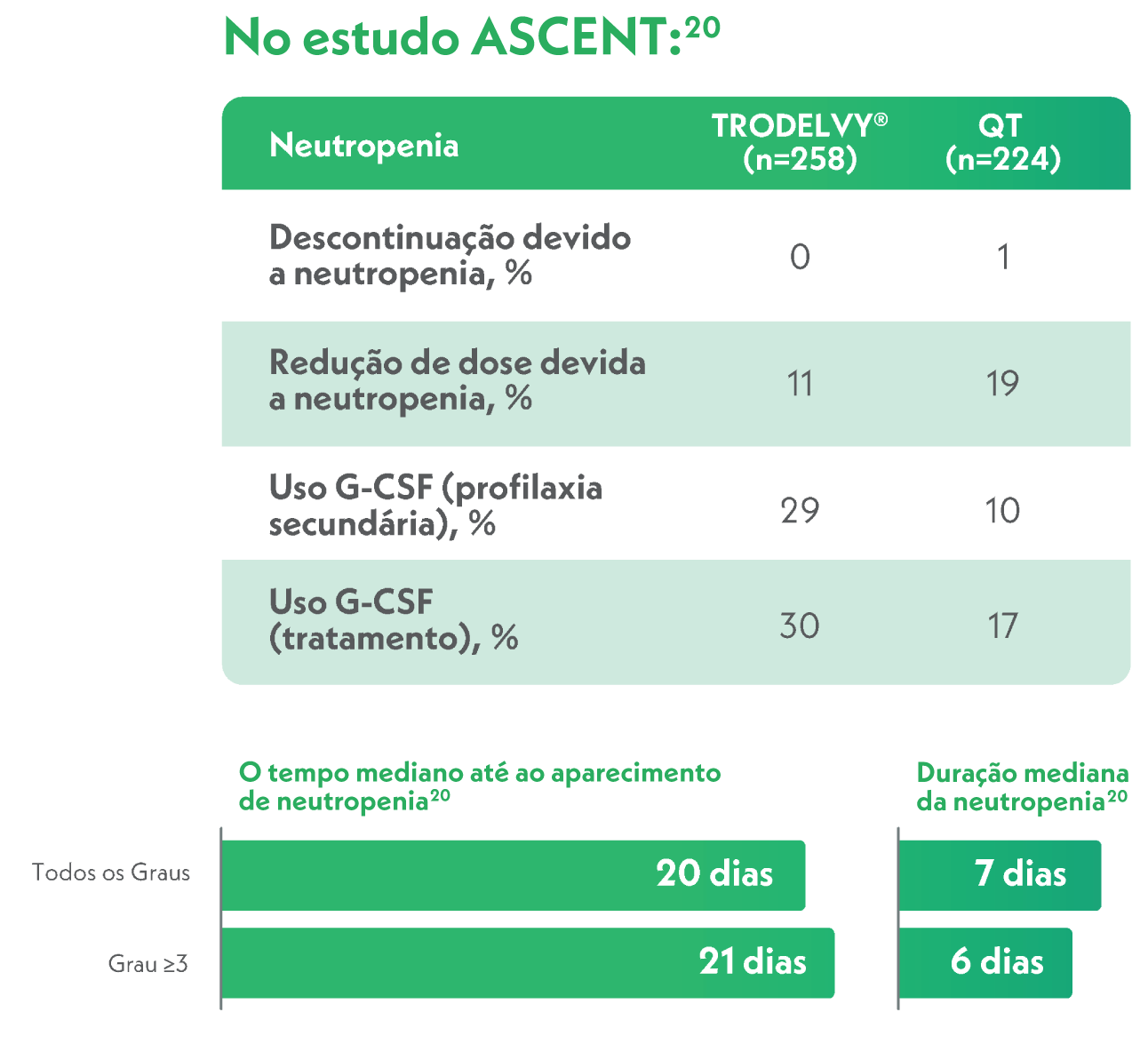
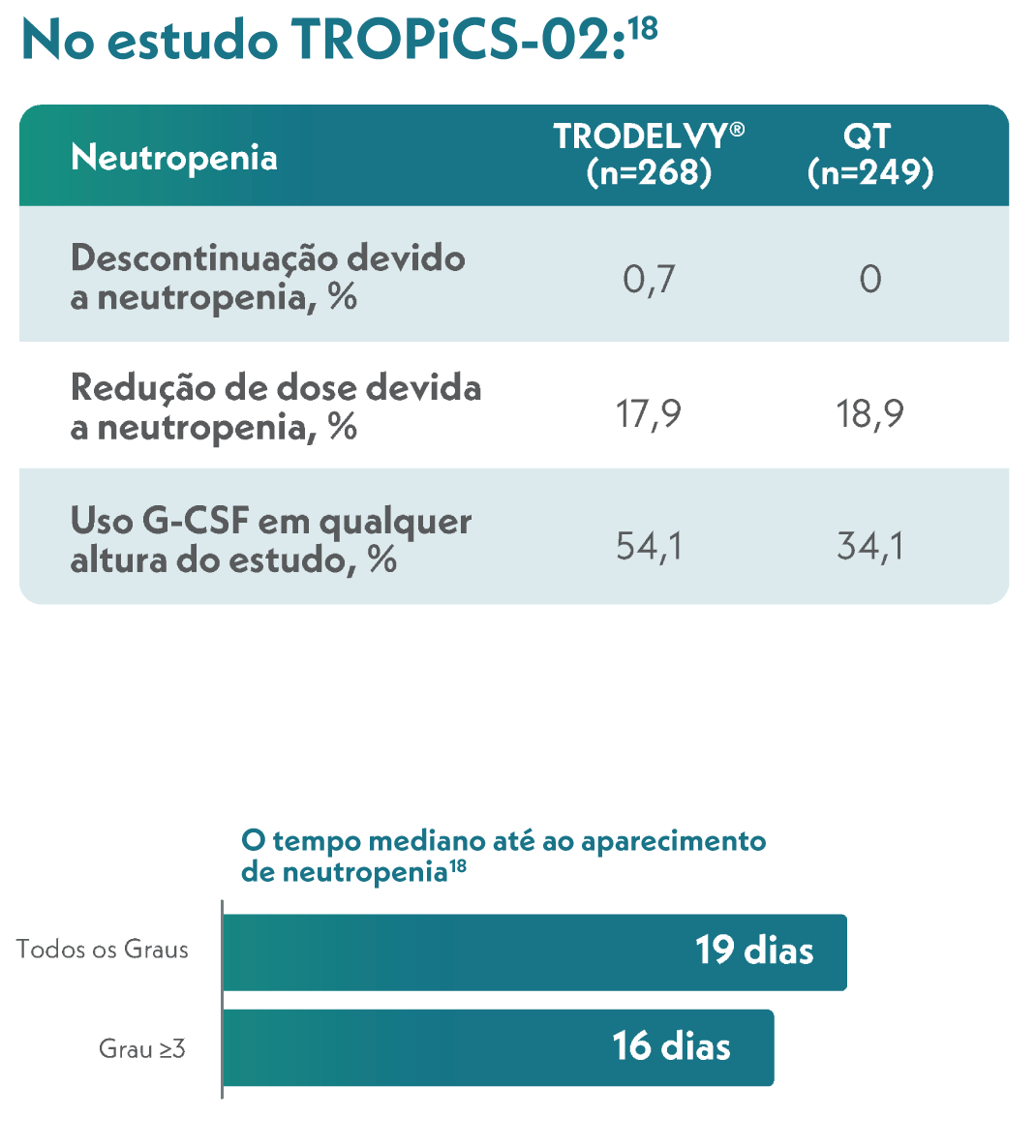
- TRODELVY não deve ser administrado se a contagem absoluta de neutrófilos for inferior a 1500/mm3 no dia 1 de qualquer ciclo ou se a contagem de neutrófilos for inferior a 1000/mm3 no dia 8 de qualquer ciclo. TRODELVY não deve ser administrado em caso de febre neutropénica9.
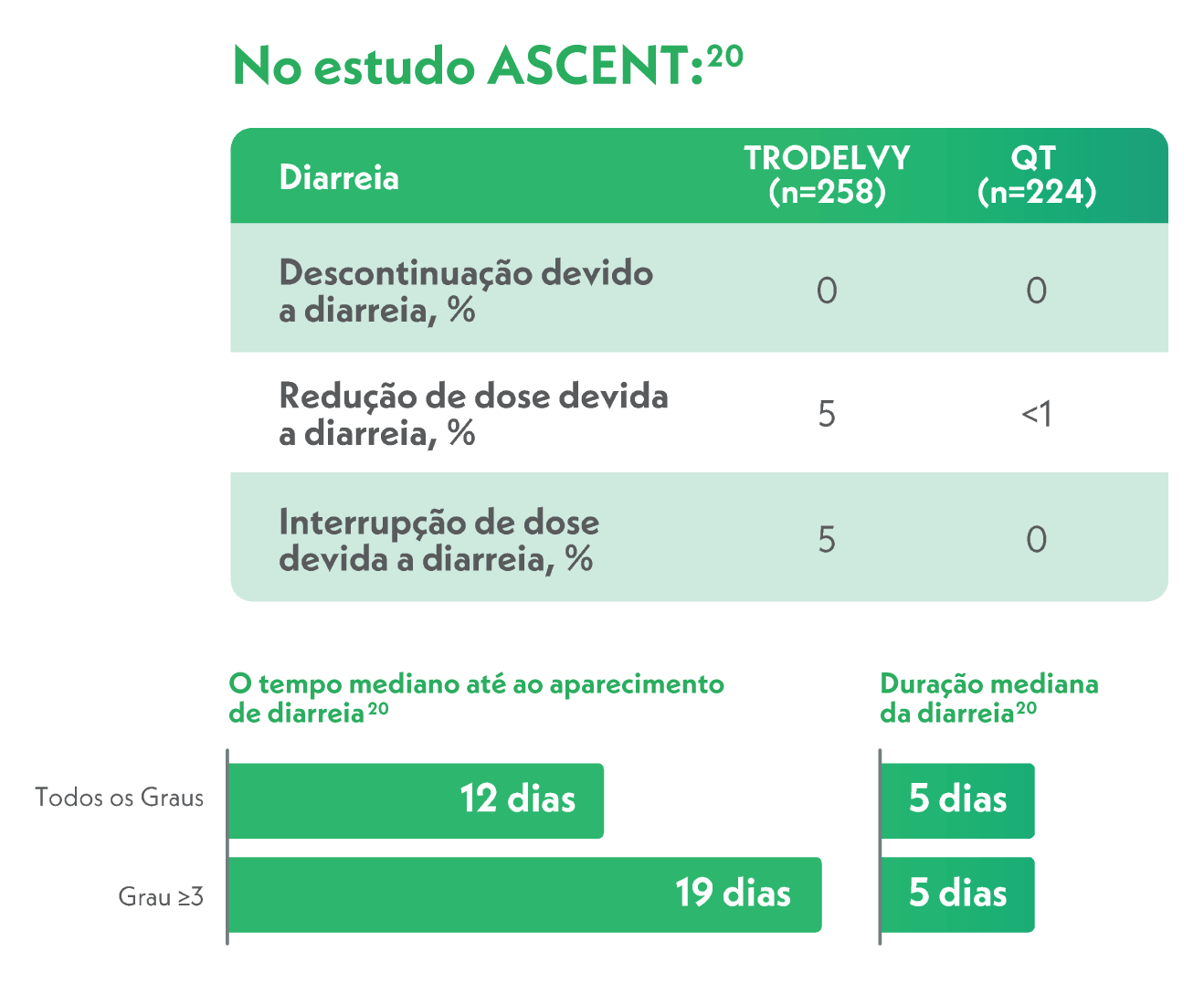
Em relação à diarreia:

Medicação associada a AEs:
Em caso de respostas colinérgicas excessivas, recomenda-se fazer9:

Em caso de diarreia, recomenda-se fazer9:

Modificações de dose recomendadas em caso de AEs não-neutropénicos9
A dose de sacituzumab govitecano não deve ser aumentada após ter sido realizada uma redução de dose devido a reações adversas9.
A dose recomendada de TRODELVY é de 10 mg/kg de peso corporal, administrada por perfusão IV nos dias 1 e 8 de ciclos de tratamento de 21 dias.

Antes da administração de cada dose de Trodelvy®▼, recomenda-se tratamento prévio.
TRODELVY®▼é moderadamente emetogénico19. Para prevenir vómitos e/ou náuseas, recomenda-se fazer 2 ou 3 medicamentos como9:

Para prevenir reações relacionadas com a perfusão, recomenda-se fazer9:

TRODELVY® tem um perfil de segurança bem definido1,11
TRODELVY®: Reações adversas muito frequentes*1
| Reações Adversas | Todos os Graus (%) n=688 | Grau ≥3 (%) n=688 |
|---|---|---|
| Neutropenia | 67,6 | 50,7 |
| Náuseas | 62,6 | 2,8 |
| Diarreia | 62,5 | 10,3 |
| Fadiga | 61,5 | 6,8 |
| Alopecia | 45,6 | 0 |
| Anemia | 40,7 | 9,3 |
| Obstipação | 36,2 | 0,4 |
| Vómitos | 33,6 | 2,5 |
| Diminuição do apetite | 25,7 | 1,3 |
| Dispneia | 22,1 | 3,1 |
| Dor abdominal | 20,2 | 2,8 |
| Neutropenia febril | 6,1 | 6,1 |
As principais advertências e precauções especiais de utilização incluem neutropenia, diarreia, hipersensibilidade, náuseas e vómitos, utilização em doentes com atividade da UGT1A1 reduzida e toxicidade embriofetal. Para mais informação sobre o perfil de segurança de Trodelvy® consultar, por favor o RCM.1
As frequências de reações adversas baseiam-se em dados agrupados provenientes de três estudos clínicos que envolvem 688 doentes que receberam 10 mg/kg de peso corporal de sacituzumab govitecano para o tratamento de CMTN e cancro da mama HR+/HER2- metastáticos.1