A PFS mediana com TRODELVY® foi ~3X SUPERIOR1
Sobrevivência livre de progressão*1
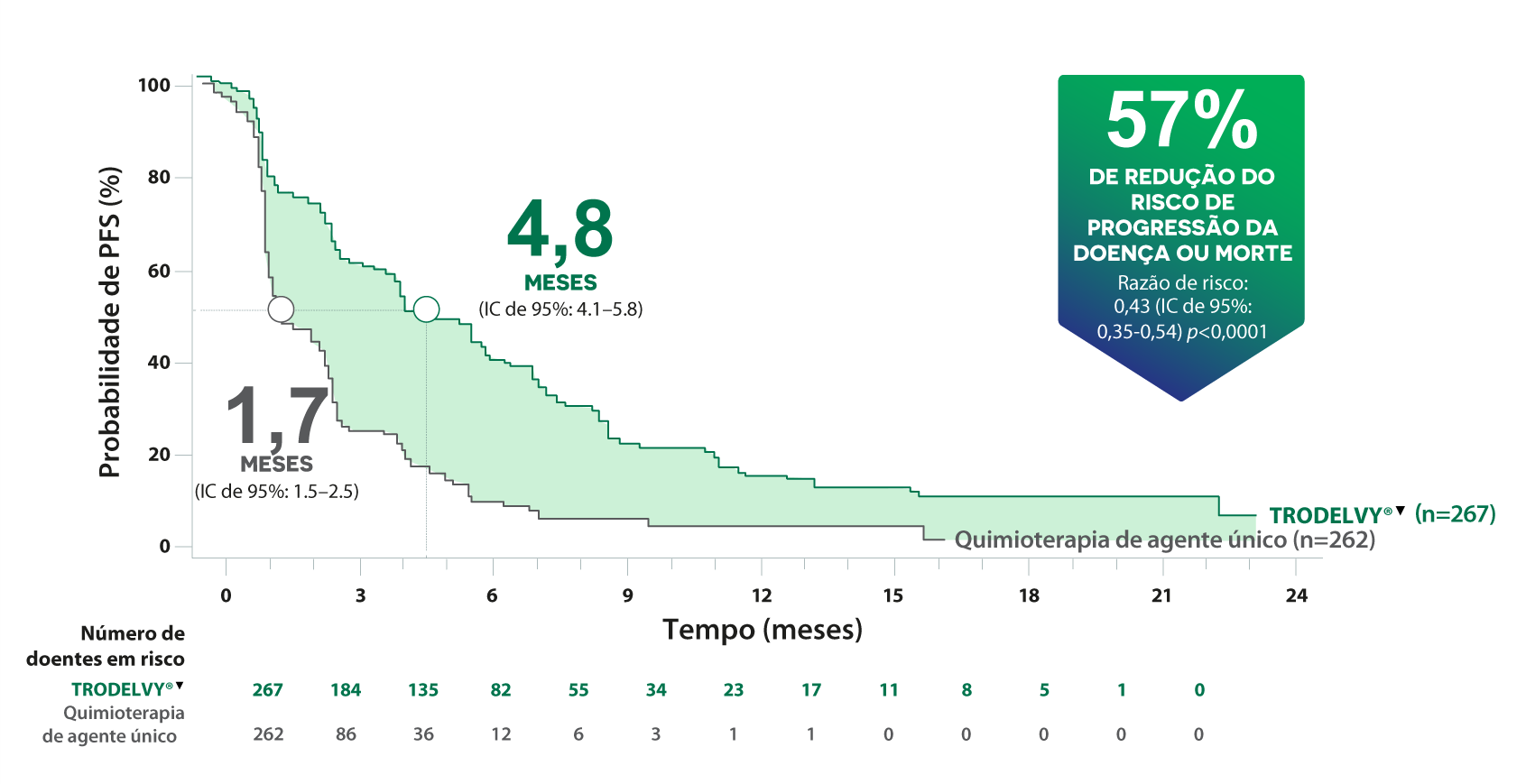
O benefício demonstrado de TRODELVY® na PFS em doentes que receberam uma linha anterior de terapêutica sistémica no contexto metastático foi consistente com os resultados na população global. Razão de risco: 0,41 (IC de 95%: 0,22-0,76).*θ1,6
*A melhoria na PFS na população de análise primária foi consistente com a população ITT (PFS mediana: 5,6 meses vs. 1,7 meses; Razão de risco: 0,41; p<0,0001). O critério de avaliação primário de eficácia foi a PFS em doentes sem metástases cerebrais no estudo (N=468).1
θAnálise Post-hoc na população de análise primária.
OS Mediana foi de 1 ANO com TRODELVY®1
Sobrevivência Global1*
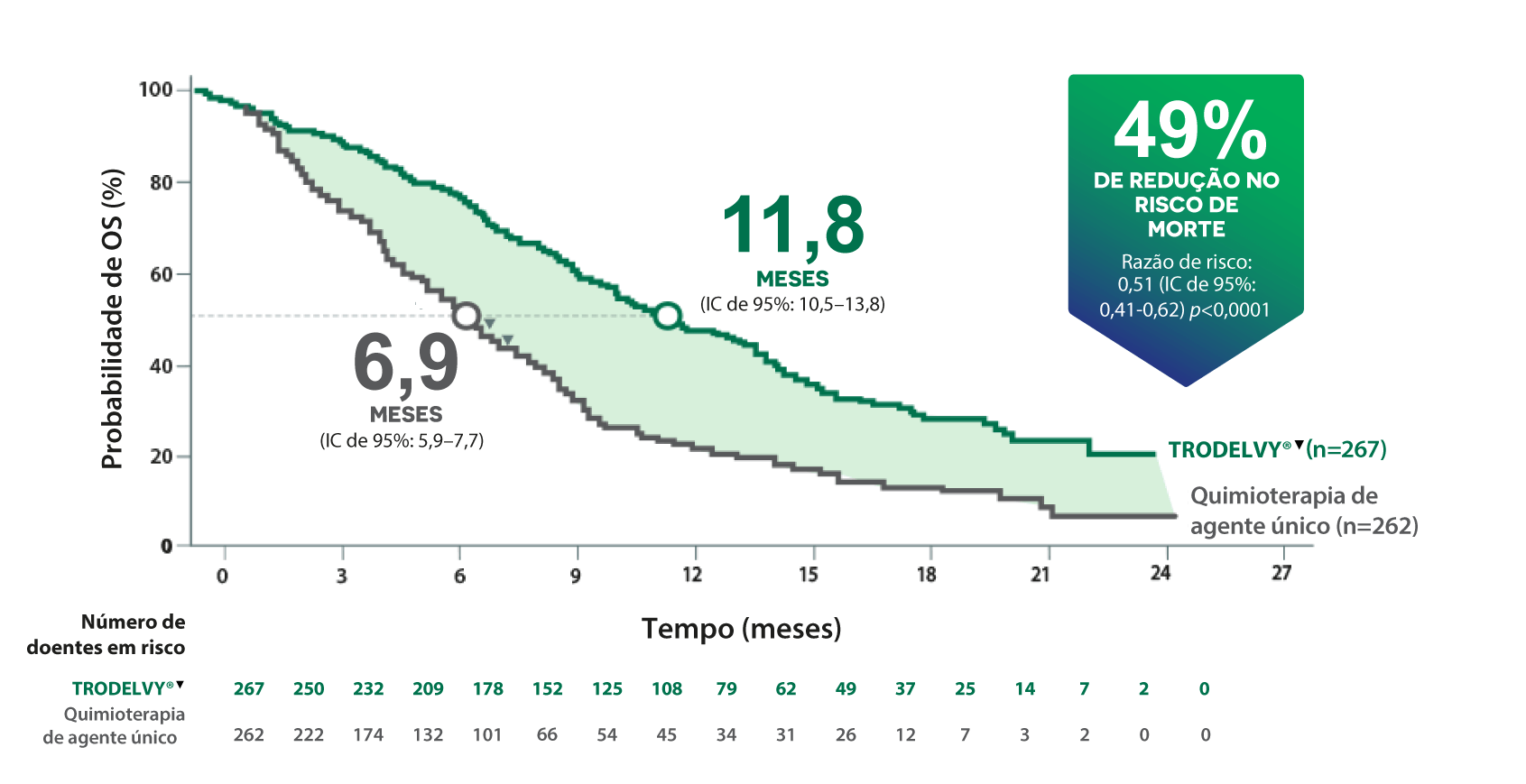
*O benefício de OS na população de análise primária foi consistente com a população ITT (OS mediana: 12,1 meses vs. 6,7 meses; Razão de risco: 0,48; p<0,0001).
A população de análise primária incluía doentes sem metástases cerebrais no início do estudo (N=468).1 A população ITT era composta por doentes com ou sem metástases cerebrais no início do estudo (N=529).1
θAnálise Post-hoc na população de análise primária.
TRODELVY® apresentou uma taxa de resposta global aproximadamente 8X superior à quimioterapia*1
Taxa de resposta global1
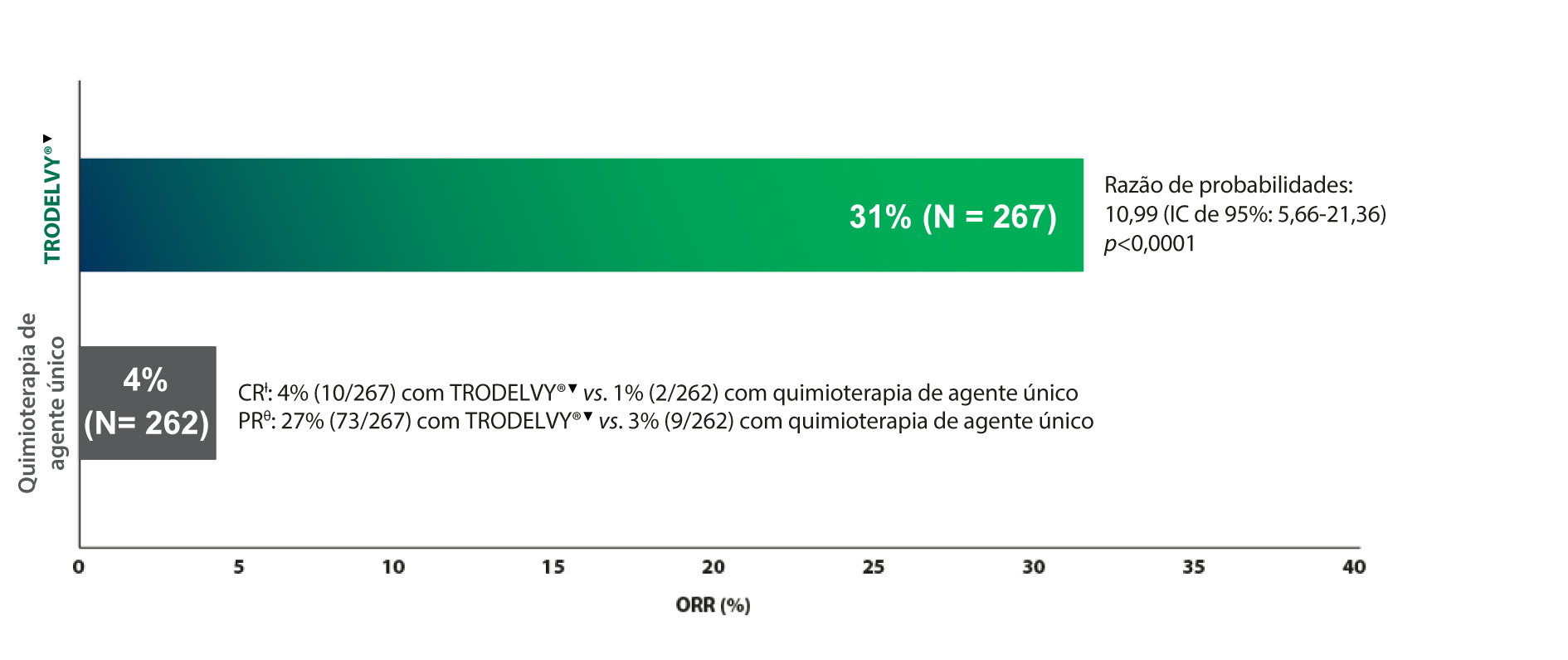
*Os resultados ORR na população de análise primária foram consistentes com a população ITT (ORR: 35% vs. 5%). A população de análise primária era composta por doentes sem metástases cerebrais no início do estudo (n=468). A população ITT era composta por doentes com ou sem metástases cerebrais no início do estudo (N=529).
†Resposta Completa (CR): Desaparecimento de todas as lesões alvo. Quaisquer gânglios linfáticos patológicos (quer sejam alvo ou não alvo) devem ter uma redução no eixo menor para <10 mm.9
θResposta Parcial (PR): Redução de pelo menos 30% na soma dos diâmetros das lesões alvo, tendo como referência a soma dos diâmetros no início do estudo.9